Soluciones Químicas
- mrojaspuello

- 20 mar 2020
- 6 Min. de lectura
Qué es Solución química:
Una solución química es la mezcla homogénea de una o más sustancias disueltas en otra sustancia en mayor proporción.
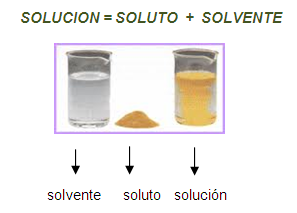
Una solución química es compuesta por soluto y solvente. El soluto es la sustancia que se disuelve y el solvente la que lo disuelve.
Las soluciones químicas pueden presentar los tres estados de la materia: líquida, física y gaseosa. A su vez, sus solutos y sus solventes también pueden presentar esos tres estados.
La mezcla del alcohol en el agua, por ejemplo, es una solución líquida de soluto y solvente líquido. El aire está compuesto de nitrógeno, oxígeno y otros gases resultando en una mezcla gaseosa. Por otra parte, las amalgamas de un soluto sólido como el oro con un solvente líquido como el mercurio da una solución sólida. Partes de una solución (componentes)
Hay dos aspectos importantes en el tema de las soluciones: el de las partes o sustancias que las forman y el de la cantidad de cada una de estas partes, principalmente el soluto. Veremos el primer aspecto.
Toda solución está formada por dos partes: el soluto y el solvente. El soluto es la sustancia que se disuelve y que está en menor cantidad en una solución; el solvente es la sustancia que se encuentra en mayor cantidad y es la que di - suelve al soluto. La solución resulta de mezclar el soluto con el solvente, y estas sustancias mezcladas tan solo experimentan un cambio físico, específica -mente el solvente (aspecto, puntos de fusión, ebullición y congelación, etc.).
En ocasiones, existe un solvente y varios solutos, y a veces varios solventes y solutos; las partículas del soluto son moléculas o iones y se encuentran dispersas y atrapadas por las moléculas del solvente, que son más abundantes y de mayor tamaño molecular.
Con respecto al solvente, se reconoce al agua como el solvente universal o más popular; cuando el agua actúa como solvente en las soluciones, entonces estas se denominan "soluciones acuosas".Sin embargo, no todas las sustancias se disuelven en el agua, sino que lo hacen en otros tipos de solventes (alcohol, etc.), por lo que las soluciones pueden ser acuosas (cuando el agua es el solven te) y no-acuosas (cuando el solvente es otra sustancia). Estados de las soluciones
Se sabe que toda la materia del mundo se presenta fundamentalmente en 3 estados físicos o de agregación, y en igual modo se presentan las soluciones en la naturaleza, así:
a. Soluciones sólidas. Todas las aleaciones, como el latón (cobre con zinc), bronce (cobre con es
b. Soluciones líquidas. Como
- Sólido en líquido: sal disuelta en agua; azúcar disuelta en agua, etc.
- Líquido en líquido: alcohol disuelto en agua, etc.
c. Soluciones gaseosas. Como el aire, que es una solución formada por varios gases (solutos), ta
les como el dióxido de carbono, oxígeno y argón, los cuales están disueltos en otro gas llama –
do nitrógeno (solvente). Otros ejemplos son la niebla y el humo.
Así, las soluciones pueden ser sólidas, liquidas y gaseosas, y estar formadas por gases (soluto) en gases (solvente), gases en líquidos, sólidos en líquidos, líquidos en líquidos y sólidos en só- lidos. Esto es que, el soluto puede ser un gas, un líquido o un sólido, e igual el solvente.
Propiedades de las soluciones
Las soluciones son materia y por lo tanto tienen propiedades, las cuales dependen principalmente de la cantidad de soluto presente en la solución. Estas propiedades reciben el nombre de "propiedades coligativas", entre las cuales están:
- La composición química de la solución es variable.
- Las propiedades químicas del soluto y del solvente no se alteran cuando se mezclan para for-
mar la solución.
- Las propiedades físicas de la solución si se alteran, principalmente las del solvente, como por
ejemplo el punto de ebullición (aumenta) y el punto de congelación (disminuye).
El agua de mar y el agua azucarada logran hervir a temperaturas mayores que la del agua, o
sea a mas de 100 oC; y estas mismas soluciones logran congelarse a temperaturas más bajas
que la del agua, es decir, menores que O oC .
Solubilidad
La solubilidad es un término que relaciona a las partes de una solución, y se refiere a la capa- cidad que tiene una sustancia (soluto) para disolverse en otra (solvente). El grado de solubilidad mide la capacidad de un soluto para disolverse en un solvente.
Existen solutos que se disuelven muy bien en el agua (sal de mesa, azúcar, etc.), por lo que su solubilidad es alta; sin embargo, sucede lo contrario con otros, que casi no se disuelven en agua (soda, etc.), siendo su solubilidad baja. Un soluto se disuelve mucho mejor cuando:
- La temperatura aumenta.
- La cantidad de soluto a disolver es adecuada.
- El tamaño de las partículas es fino.
Respecto a la cantidad del soluto, algunos líquidos, como el agua y el alcohol, tienen la capaci dad de disolverse entre ellos mismos y en cualquier proporción. En una solución de sal y agua, puede suceder que, si se sigue agregando sal, se llegue a un punto en el que el agua ya no disolve rá más sal, pues la solución estará saturada; esto es, se llega a un punto en que el soluto ya no se disuelve en el solvente, dicho a la inversa, el solvente llega al punto en el que no tiene más capa cidad para disolver más soluto. Si a un vaso con agua se le agrega y se le agrega azúcar, el solven te (agua) llegara a un punto en que admitirá más azúcar pero no la disolverá; el exceso de soluto (azúcar) buscara el fondo del recipiente, y cuando esto sucede indica que la solución esta satu- rada.
Un mismo soluto muestra varios grados de solubilidad, según sea el tipo de solvente, tempera- tura y presión; también se afirma que las sustancias que actúan como solutos no se disuelven en igual medida en un mismo disolvente. En la mayor parte de los casos, la solubilidad aumenta al aumentar la temperatura, y en otros, la solubilidad disminuye al aumentar la temperatura; tam-bien la solubilidad aumenta o disminuye según sea la clase de soluto, por ejemplo, la sal de coci - na, el azúcar y el vinagre son muy solubles en agua, pero no así el bicarbonato de sodio.
Tipos de soluciones (concentración de las soluciones)
Las soluciones se pueden clasificar de dos maneras: según la cantidad de soluto presente en la solución (concentración), y según el tamaño o diámetro de las partículas del soluto (suspensio nes, soluciones coloidales y soluciones verdaderas). Las soluciones varían entre sí por su concentración, y una misma clase de solución puede pre sentar diferentes tipos de concentraciones; por ejemplo, si se tienen tres vasos llenos de agua y al primero se le agrega una cucharada de azúcar, al segundo tres cucharadas y al último seis, en- tonces se está ante una misma clase de solución (agua azucarada) y tres diferentes tipos de con -centración. En base a la cantidad de soluto presente en las soluciones, estas se clasifican en:
a. Solución diluida o insaturada. Es aquella en la que existe mucho menos soluto y mucho más solvente.
b. Solución saturada. Es aquella que contiene la máxima cantidad de soluto que el solvente puede diluir o deshacer, por lo tanto, cualquier cantidad de soluto que se añada no se disolverá; la solución sigue teniendo menos soluto y más solvente.
c. Solución sobre-saturada. Las cantidades extras de soluto agregadas a la solución saturada ya no se disuelven, por lo que se dirigen hacia el fondo del recipiente (precipitado). Hay exceso de soluto, pero siempre hay más solvente.
d. Solución concentrada. Es aquella cuya cantidad de soluto es mayor que la del solvente.
Concentración de una solución química
La concentración es una magnitud que describe la proporción de soluto respecto al solvente en una disolución. Esta magnitud se expresa en dos tipos distintos de unidades, que son:
Unidades físicas. Aquellas que se expresan en relación al peso y el volumen de la solución, en forma porcentual (se multiplican por 100). Pueden ser las siguientes:
%Peso/peso. Se expresa en gramos de soluto sobre gramos de solución.%Volumen/volumen. Se expresa en cc de soluto sobre cc de solución.%Peso/volumen. Combina las dos anteriores: gr de soluto sobre cc de solución.
Unidades químicas. Aquellas que se expresan en sistemas de unidades químicas, como pueden ser:
Molaridad (M). Se expresa en número de moles de soluto sobre un litro de solución o un kilogramo de solución.Fracción molar (Xi). Se expresa en términos de moles de un componente (solvente o soluto) en relación con los moles totales de la solución, de la siguiente manera:
Xsolución = moles de soluto / moles de soluto + moles solvente
Xsolvente = moles de solvente / moles de soluto + moles solvente
Siempre contemplando que:
Xsolvente + Xsolución = 1
Profundizar en: https://www.monografias.com/trabajos97/soluciones-quimicas/soluciones-quimicas.shtml
Ver el siguiente video: https://www.youtube.com/watch?v=4pvBPfxoFsA

Comments